论文导读::以中油桃7号为试材。采用Fluo-3AM-ester探针研究桃不同组织的Ca。
论文关键词:桃,Ca2+信号,激光扫描共聚焦显微镜,Fluo-3AM-ester
钙(Ca)作为植物必需的一种矿质元素在自然界含量相当丰富,它能够以Ca2+的形式被根吸收并在植物生长发育和应对环境胁迫中处于中心调控地位[[1]]。作为植物信号传导中的第二信使[[2]],在植物应对环境刺激时,胞质内钙离子浓度的改变是一重要的网络信号。同时钙在果实耐贮性以及品质方面有重要作用,如果实的钙含量的提高有利于维持细胞壁的强度和膜的完整性,保持果实硬度,提高果实品质[[3][4]’[5]]。
激光扫描共聚焦显微镜 (Laser Scanning Confocal Microscope LSCM)是20世纪80年代发展起来的细胞生物学分析仪,与传统光学显微镜相比生物论文,它具有更高的分辨率和清晰度,实现多重荧光的同时观察并可形成清晰的三维图象等优点。利用荧光探针标记,LSCM可以对细胞内微细结构和离子的动态变化进行定性、定量、定时和定位分析,为我们对组织细胞的研究提供了新的手段[[6]]。Fluo-3 AM是一种长波钙荧光探针,它的吸收和发射峰为506和526 nm,能被488nm的氩激光激发,若以游离配体形式存在时几乎是非荧光性的,但是当它与钙离子结合后荧光会增加40至200倍,所以Fluo-3-AM 常作为研究Ca2+信号的荧光染料[[7]-[8]]。本研究建立了采用Fluo-3 AM-ester为探针研究桃不同组织的Ca2+荧光信号特征分布,为进一步研究Ca2+对果实品质的影响,合理喷施钙元素提供理论依据。
1、材料、方法
1.1 材料
材料取自中国农业科学院郑州果树研究所桃育种课题组品种资源圃,以中油桃7号为试材,每10天喷1.0 % CaNO3。我们选取成熟果实和同时期的叶柄用来分析钙离子信号论文格式模板。
1.2 方法
1.2.1材料制备及探针杂交 采用徒手切片法,用剃须刀片将果实切取约1mm的厚度。将Fluo-3-AM(BiotiumUSA)50μg溶于45μl DMSO (lmM),15μl/支分装,冻存。25μgPluronic F-127溶于75μl DMSO (25%,40℃溶解20分钟)生物论文,室温保存。用含HEPES的缓冲液将1mM Fluo-3-AM稀释成10μM,每ml染液中再加入5μlPluoronic F127。具体操作步骤如下:(1)将切取组织放入1.5ml离心管;(2)用HEPES缓冲液漂洗2次 ;(3)用200μl的Fluo-3 AM-ester(10μM),37℃避光孵育60分钟;(4)再用HEPES缓冲液漂洗3次;(5)放在载玻片上进行观察。
1.2.2图像采集及分析 Ca2+荧光信号图像的采集采用Leica SP5 激光共聚焦扫描显微镜,制片后立即进行观察。采用Argon激发光(波长488 nm)和透射光Transmission(DIC)扫描,选择XYZ扫描模式。荧光扫描参数设置为:Gain值:500;分辨率(Resolution):8Bit;像素格式(Pixel Format):512*512 pixels;扫描速度(Scanning Speed)400Hz;针孔大小(Pinhole Size):53;线平均(Line Averaging):1;面平均(Frame Averaging):1;累加(Accumulation):1。图像文件均储存于计算机中,并以512*512像素类型保存。最大和最小相对荧光强度采用线定量分析法,
2、结果与分析
2.1 Ca2+信号荧光相对强度
我们对的桃叶柄(图1、2)和果肉组织(3、4)中Ca2+的荧光信号强度进行了线性相对定量分析,从表1可以看出叶柄中10×物镜下最大相对荧光信号强度为218.32,最小相对强度为36.68, 20×物镜下最大相对荧光信号强度为212.21,最小相对强度为42.79;果肉组织中10×物镜下最大相对荧光信号强度为189.9 7,最小相对强度为45.03;20×物镜下最大相对荧光信号强度为176.07,最小相对强度为40.93。同一组织不同倍性物镜观察下相对最大荧光强度变化不大。
2.1在不同组织中的分布
通过比较Ca2+在桃叶柄和果肉组织中的荧光信号特征分布和强度,我们可以看出Ca2+在细胞壁和胞间均有分布,叶柄组织细胞中分布相对较均匀,而在果肉组织中分布相对不均匀,虽然果实和叶柄中最大相对荧光强度相差不大,但在果实中Ca2+分布相对叶柄中较少生物论文,这可能与Ca2+在叶柄和果肉组织中的作用有关,叶柄作为重要的矿质元素运输通道,Ca2+参与许多重要的生理和代谢途径。但在果实中Ca2+作用相对于叶柄比较小。
表1 不同组织及放大倍数Ca2+信号强度分析
Table 1 Ca2+signalintensity analysis of different tissue and magnification
|
样品 最大值 最小值
Sample Maximum Minimum
|
|
叶柄(10×) 218.32 36.68
叶柄(20×) 212.21 42.79
果肉(10×) 199.97 45.03
果肉(20×) 204.07 40.93
|
 
图1. 桃叶柄中游离Ca2+荧光信号特征(10×)。A: Argon荧光激发下Ca2+荧光信号特征;B:透射光观察下叶柄组织结构;C: A、B的叠加图;D: 3D成像图
Figure 1.Ca2+ fluorescence signal characteristic (10×)。A: Ca2+ fluorescence signal characteristic excited byargon-ion laser sources, B: Petiole structure scanned in transmitted lightfield, C: Combination of A and B, D: Three dimension imagination.
 
图2. 桃叶柄中游离Ca2+荧光信号特征(20×)。A: Argon荧光激发下Ca2+荧光信号特征;B: 明场透射光观察下叶柄组织结构;C: A、B的叠加图;D: 3D成像图

C
|
D
|
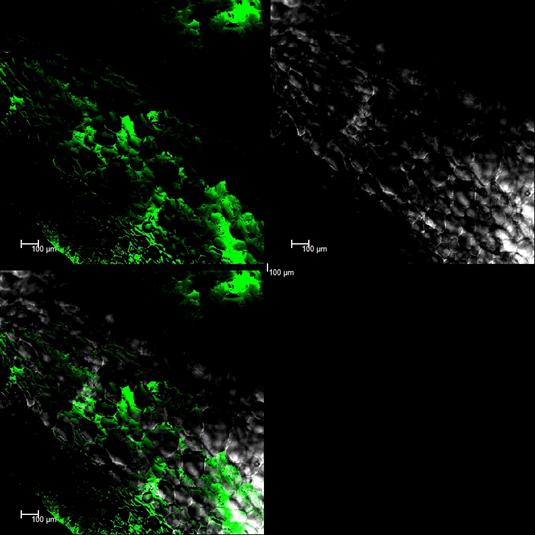
图3. 桃果实中游离Ca2+荧光信号特征(10×)。A: Argon荧光激发下Ca2+荧光信号特征;B: 明场透射光观察下叶柄组织结构;C: A、B的叠加图;D: 3D成像图

D
|
B
|
A
|
C
|

图4. 桃果实中游离Ca2+荧光信号特征(20×)。A: Argon荧光激发下Ca2+荧光信号特征;B: 明场透射光观察下叶柄组织结构;C: A、B的叠加图;D: 3D成像图
3、讨论
细胞内Ca2+信号定量技术有多种,主要有荧光探针法[[9]]、Ca2+敏感微电极法[[10]]以及发光蛋白荧光染色法等[[11]]论文格式模板。目前,荧光探针法是最常用的定量方法,而且已广泛应用于细胞内钙的测定,特别用于测定动植物细胞内游离Ca2+浓度[7,[12]-[13]]。Fluo-3 AM-ester荧光探针一种可以穿透细胞膜的荧光染料,主要是通过与细胞内和细胞间游离的钙离子结合对Ca2+信号分布进行定量分析[11],它可以灵敏反映细胞内游离钙离子浓度变化。Fluo-3 AM进入细胞后经非特异性酯酶脱去AM,成为Fluo-3留在细胞内。Fluo-3与细胞内游离钙结合后,其荧光强度是本身的40倍以上。一般在活体细胞中进行,所以很难采用组织石蜡切片的方法进行,因此切片的厚度是获得清晰图像的关键,本研究中采用徒手切片的方法能够很清晰的观察到荧光信号及植物细胞的基本架构。
作为植物最重要的矿质元素之一,钙离子在植物细胞壁、细胞膜以及液泡中分布比较广泛,并行使着重要功能[[14]],植物主要通过根吸收周围环境中的游离的钙生物论文,在植物的不同部位起着不同的作用。齐开杰等[[15]]研究表明植物不同部位钙的含量不同,叶片的钙含量最高,认为长距离运输的主要动力是蒸腾作用,而叶片是主要的蒸腾器官,叶柄是连接茎和叶片之间的营养物质和同化物质的重要通道,这也可能是叶柄积累大量钙的原因。在桃果肉中,Ca2+信号主要分布在细胞壁,有研究表明内源钙含量的提高有利于维持细胞壁的强度和膜的完整性, 提高果实品质[3]。Biggs等[[16]]研究表明采前喷施钙能有效减少桃果实腐烂、保持果实硬度和改善果实外观等作用。这些研究结果都表明细胞壁是果肉中钙的主要分布区。本研究中,虽然叶柄和果肉中Ca2+的最大荧光相对量相差不大,但叶柄中钙的含量和分布明显大于果肉中的,这与前人研究结果一致。
参考文献Reference
[1]Hepler P K. Calcium, a central regulator of plantgrowth and development. Plant Cell,2005,17: 2142 - 2155.
[2]NicolaH. Evans, Martin R. McAinsh, Alistair M. Hetherington and Marc R. Knight. ROSperception in Arabidopsis thaliana: the ozone-induced calcium response. ThePlant Journal, 2005, 41: 615 - 626.
[3]朱竹,孟祥红,田世平.采前喷施草酸对芒果果实细胞钙含量和分布的影响.植物学报,2010,45(1):23-28.
ZhuZhu,XianghongMeng,ShipingTian.EffectofPreharvestOxalicAcidSpraysonCalciumContentandDistributioninMangoFruitCells.ChineseBulletinofBotany2010,45(1):23–28.
|